लेखक:
Louise Ward
निर्मितीची तारीख:
11 फेब्रुवारी 2021
अद्यतन तारीख:
1 जुलै 2024

सामग्री
अणूचा आकार इतका छोटा आहे की रासायनिक संयुगातील अणूची संख्या अचूकपणे मोजणे कठीण आहे. पदार्थांचे प्रमाण अचूकपणे मोजण्यासाठी, वैज्ञानिक विशिष्ट प्रमाणात अणूंचे प्रतिनिधित्व करण्यासाठी मोलचे एकक वापरतात. पदार्थाचा एक तीळ 12 कार्बन समस्थानिकेच्या 12 ग्रॅममध्ये असलेल्या कार्बन अणूंच्या संख्येच्या समतुल्य म्हणून परिभाषित केला जातो, जो सुमारे 6,022 x 10 अणू आहे. या मूल्याला अॅव्होगॅड्रो क्रमांक किंवा अॅव्होगॅड्रो स्थिर म्हणतात. याला कोणत्याही घटकाच्या 1 तीळातील अणूंची संख्या आणि पदार्थाच्या वस्तुमानाच्या 1 मोलला त्या पदार्थाचा रवाळ द्रव्यमान असेही म्हणतात.
पायर्या
पद्धत 1 पैकी 2: एखाद्या घटकाच्या मोलर मासांची गणना करा
मोलर मास व्याख्या. त्या पदार्थाचा मोल मास त्या पदार्थाच्या एका तीळचा (ग्रॅममध्ये) वस्तुमान असतो. एखाद्या घटकाच्या मोलार वस्तुमानाची गणना करण्यासाठी, त्याचे अणू द्रव्य ग्रॅम-प्रति-मोल रूपांतरण घटक (जी / मोल) ने गुणाकार करा.
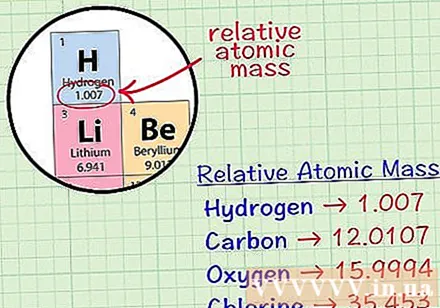
घटकाचे सरासरी क्यूबिक अणू शोधा. एका घटकाचे सरासरी द्रव्यमान अणू म्हणजे परमाणु युनिट्समध्ये, त्या घटकाच्या समस्थानिकांमधील सर्व घटकांचा समावेश असलेल्या नमुन्यात सरासरी वस्तुमान. ही माहिती बहुधा घटकांच्या नियतकालिक सारणीवर दिली जाते. घटक शोधून काढल्यास आपल्याला त्या घटकाच्या रासायनिक चिन्हाच्या खाली लिहिलेले सरासरी क्यूबिक अणू सापडतील. हे मूल्य पूर्णांक नसून दशांशसह संख्या आहे.- उदाहरणार्थ, हायड्रोजनसह, सरासरी द्रव्यमान अणू 1.007 आहे; कार्बनचे सरासरी क्यूबिक अणू 12,0107 आहे; ऑक्सिजनचे सरासरी वस्तुमान अणु 15,9994 आहे; क्लोरीनचे सरासरी अणु द्रव्यमान 35,453 आहे.

दाढ मास स्थिरतेद्वारे सरासरी वस्तुमान अणूचे गुणाकार करा. वितळलेल्या वस्तुमानाच्या युनिटचे प्रमाण प्रति तील ०.००१ किलोग्राम किंवा प्रत्येक मोलसाठी १ ग्रॅम असे केले जाते. क्षुद्र द्रव्यमान अणूचे व दाताचे द्रव्यमान निरंतर अणू द्रव्यमानाच्या युनिटला प्रति तीळ ग्रॅममध्ये रुपांतरीत करते, म्हणून हायड्रोजनचे दाणे द्रव्यमान प्रति तीळ 1.007 ग्रॅम असेल, कार्बनचे 12 आहे. , 0107 ग्रॅम प्रति तीळ, ऑक्सिजनचे प्रति तीळ 15,9995 ग्रॅम आणि क्लोरीन प्रति तीळ 35,453 ग्रॅम आहे.- दोन किंवा अधिक अणूंचा समावेश असलेल्या रेणू म्हणून काही घटक निसर्गात अस्तित्वात असतात. म्हणजेच, जर आपल्याला हायड्रोजन गॅस, ऑक्सिजन वायू किंवा क्लोरीन गॅस सारख्या एकापेक्षा जास्त अणूपासून बनलेल्या यौगिकांच्या मोलार मासांची गणना करायची असेल तर आपल्याला कंपाऊंडचा सरासरी अणु द्रव्य निश्चित करणे आणि हे मूल्य गुणाकार करणे आवश्यक आहे. दाढ मास स्थिरतेसह, '' नंतर '' आपण नुकतेच आढळलेले उत्पादन गुणाकार करा.
- सह एच2: प्रति मोल 1,007 x 2 = 2,014 ग्रॅम; ओ साठी2: 15,9994 x 2 = 31,9988 ग्रॅम प्रति मोल; आणि सी.एल.2: 35,453 x 2 = 70,096 ग्रॅम प्रति मोल.
पद्धत 2 पैकी 2: कंपाऊंडच्या मोलर मासची गणना करा

कंपाऊंडचे स्ट्रक्चरल सूत्र निश्चित करा. पदार्थाचे स्ट्रक्चरल सूत्र प्रत्येक घटकाची अणु संख्या देते जे त्या संयुगे बनवते. (ही माहिती सर्व संदर्भ पुस्तकांमध्ये उपलब्ध आहे). उदाहरणार्थ, हायड्रोक्लोरिक acidसिडचे रासायनिक सूत्र एचसीएल आहे; ग्लूकोजचे सी आहे6एच12ओ6. या संरचनात्मक सूत्राद्वारे, आम्ही विचाराधीन कंपाऊंड बनवणार्या प्रत्येक प्रकारच्या अणूची संख्या निर्धारित करू शकतो.- जेथे एचसीएलमध्ये एक हायड्रोजन अणू आणि एक क्लोरीन अणू आहे.
- ग्लूकोज साखर रेणू सी6एच12ओ6 6 कार्बन अणू, 12 हायड्रोजन अणू आणि 6 ऑक्सिजन अणू आहेत.
प्रत्येक घटक घटकाचे सरासरी द्रव्य अणू निश्चित करा. कंपाऊंडमध्ये उपस्थित असलेल्या प्रत्येक घटकाचे सरासरी वस्तुमान अणू शोधण्यासाठी नियतकालिक सारणीचा वापर करा. नियतकालिक सारणीवर साधारण द्रव्यमान अणू घटकांच्या रासायनिक चिन्हाखाली लिहिले जाते. एखाद्या घटकाच्या मोलर मासांची गणना करण्यासारखेच, सरासरी वस्तुमान अणू 1 ग्रॅम / मोलने गुणाकार करा.
- हायड्रोक्लोरिक acidसिड तयार करणार्या घटकांचे सरासरी वस्तुमान अणु खालीलप्रमाणे आहे: हायड्रोजन 1,007 ग्रॅम / मोल आणि क्लोरीन 35,453 ग्रॅम / मोल.
- ग्लूकोज रेणू बनविणार्या घटकांचे सरासरी वस्तुमान अणू आहेत: कार्बन, 12,017 ग्रॅम / मोल; हायड्रोजन, 1,007 ग्रॅम / मोल; आणि ऑक्सिजन, 15.9995 ग्रॅम / मोल.
प्रत्येक घटक घटकाची मोलार मास मोजा. एखाद्या घटकामध्ये असलेल्या घटकाच्या अणूंच्या संख्येने घटकाच्या वस्तुमान अणूचे गुणाकार केल्याने कंपाऊंडमधील घटकाची सरासरी वस्तुमान मिळते.
- हायड्रोक्लोरिक acidसिड, एचसीएलच्या बाबतीत, हायड्रोजन घटकातील मोलार द्रव्यमान 1,007 ग्रॅम / मोल आहे आणि क्लोरीनचे प्रमाण 35,453 ग्रॅम / मोल आहे.
- ग्लूकोजच्या बाबतीत, सी6एच12ओ6, प्रत्येक घटकाचा दाढीचा मास खालीलप्रमाणे आहेः कार्बन, 12,0107 x 6 = 72,0642 ग्रॅम / मोल; हायड्रोजन, 1,007 x 12 = 12,084 ग्रॅम / मोल; ऑक्सिजन, 15,9995 x 6 = 95,9964 ग्रॅम / मोल.
घटक घटकांची एकूण चौरस वस्तुमान. कंपोस्टिंग घटकांचा एकूण रवाळ द्रव्यमान कंपाऊंडचा दाढीचा मास आहे.मागील चरणात आम्ही कंपाऊंडमध्ये उपस्थित असलेल्या प्रत्येक घटकाच्या मोलर मासांची गणना केली, या चरणात आपल्याला फक्त या सर्व मूल्ये जोडण्याची आवश्यकता आहे.
- हायड्रोक्लोरिक acidसिडचे मोलर द्रव्यमान 1,007 + 35,453 = 36,460 ग्रॅम / मोल आहे. 36.46 ग्रॅम हायड्रोक्लोरिक acidसिडच्या 1 मोलचा द्रव्यमान आहे.
- ग्लूकोजचे मोलर मास 72,0642 + 12,084 + 95,9964 = 180,1446 ग्रॅम / मोल आहे. तर ग्लूकोजच्या प्रत्येक मॉलमध्ये 180.14 ग्रॅमचा वस्तुमान असतो.
सल्ला
- जरी बहुतेक प्रकरणांमध्ये सरासरी वस्तुमान अणू जवळच्या 1 भाग 1000 (4 दशांश स्थाने) वर नोंदविले गेले असले तरी प्रयोगशाळांमध्ये, मोलार मास बहुतेकदा 2 दशांश ठिकाणी कमी केला जातो, कधीकधी मोठ्या रेणूंसाठी देखील कमी. म्हणून, प्रयोगशाळेच्या बाबतीत, हायड्रोक्लोरिक acidसिडचे मोलार द्रव प्रति मोल ग्लूकोज 180.14 ग्रॅमसाठी प्रति मोल 36.46 ग्रॅम असे लिहिले जाऊ शकते.
आपल्याला काय पाहिजे
- रासायनिक संदर्भ पुस्तक किंवा घटकांची नियतकालिक सारणी
- संगणक